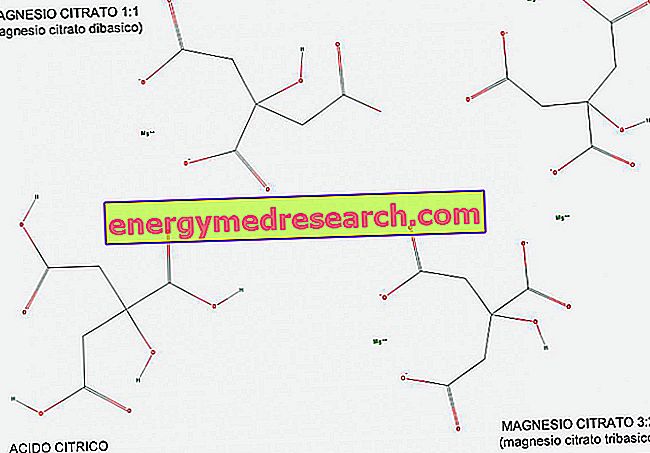
الحمض القاعدي (أو triprotic) هو حمض يحتوي على ثلاثة أيونات هيدروجين يتم التبرع بها في تفاعل حمض قاعدي. وبمساعدة الشكل ، يمكننا أن نرى كيف أن حمض السيتريك هو مثال على حمض tribasic ، لأنه يحتوي على ثلاث مجموعات كربوكسيلية COOH يمكن أن تسفر بسهولة عن الهيدروجين H.
توجد سترات المغنيسيوم في نسبة 1: 1 (1 جزيء مغنيسيوم لكل جزيء سيترات) ، ونسبة 3: 2 (3 جزيئات مغنيسيوم لكل جزيئتي سيترات).
يسمى سترات المغنيسيوم 1: 1 ثنائي القاعدة لأنه ملح ثنائي القاعدة لحمض الليمون. في الواقع ، لديها مجموعتان أساسيتان غير متكافئتان (COO-) لكل جزيء ، مستمدة من مجموعتي الكربوكسيل التي تخلت عن الهيدروجين أثناء التفاعل.
المغنيسيوم 3: 2 ، من ناحية أخرى ، يسمى tribasic لأنه يحتوي على 3 مجموعات أساسية غير متكافئة (COO-) لكل جزيء ، مستمدة من مجموعات الكربوكسيلية 3 التي تخلت عن الهيدروجين أثناء التفاعل.
من الواضح أن سيترات المغنيسيوم القبلية غنية بالمغنيسيوم (+ 42.6٪ بالوزن) من سيترات المغنيسيوم ثنائية القاعدة. علاوة على ذلك ، هو أكثر قلوية ، لأنها يمكن أن تقبل ثلاثة أيونات الهيدروجين H + ضد الاثنين المقبولة من قبل dibasic. ومع ذلك فهو أقل قابلية للذوبان في الماء.



