عمومية
الورم النقوي المتعدد هو ورم خبيث يصيب بعض خلايا الجهاز المناعي ، مما يؤدي إلى إلحاق الضرر بأعضاء وأنسجة مختلفة. يتطور بشكل عام لدى الأشخاص فوق سن الخمسين ويصاحبه في كثير من الأحيان الألم والكسور وتدمير العظام.
يتم تشخيص الورم النخاعي المتعدد مع اختبارات الدم ونخاع العظم ، الرحلان الكهربائي للبروتين في البول والتحقيقات الإشعاعية. يمكن تحفيز إهمال المرض عن طريق الستيرويدات والعلاج الكيميائي ومثبطات البروتيزوم والأدوية المناعية (مثل الثاليدومايد أو ليناليوميد) وزرع الخلايا الجذعية.
الأسباب
الأسباب التي تسبب المايلوما المتعددة غير معروفة جزئيا. من الإحصائيات الطبية ، تم اكتشاف أن الإصابة تزيد في الأشخاص المعرضين للإشعاعات المؤينة أو إلى مواد كيميائية معينة (المشتقات النفطية والهيدروكربونات الأخرى ، المذيبات ، المبيدات الحشرية ، الأسبستوس ، إلخ). العوامل الوراثية المألوفة ، التحفيز المستضدي المتكرر والعوامل الفيروسية قد تشارك أيضا في مسببات الورم النخاعي المتعدد.
الأعراض
لتعميق: أعراض المايلوما المتعددة
يحدث الورم النخاعي المتعدد في الغالب في أواخر العمر (أكثر من 50 عامًا). يمكن أن تختلف العلامات والأعراض بشكل كبير من شخص لآخر ، حيث أن العديد من الأعضاء قد تكون متورطة في المرض. في البداية ، قد لا تسبب الحالة أي أعراض. مع تقدم المرض ، من المرجح أن تحدث الأعراض المرتبطة بتسلل الأعضاء إلى البلازما والأنتاج المفرط للجلوبيولينات المناعية الوحيدة النسيلة:
- آلام العظام. ألم العظام يؤثر على ما يقرب من 70 ٪ من المرضى الذين يعانون من المايلوما المتعددة وهو العرض الأكثر شيوعا. وهي تقع أساسا على مستوى العمود الفقري والحوض والأضلاع والعظام الطويلة والجمجمة. الأعراض الأولية هي "pseudoreumatica" ، في حين أن الألم الموضعي الحاد والمستمر يمكن أن يشير إلى كسر العظام المرضية. يمكن أن يؤدي تدخل الفقرة إلى ضغط الحبل الشوكي. في الورم النخاعي المتعدد ، يكون تلف العظام ثانويا بالنسبة لظهور آفات "ليترية" وإلى هشاشة العظام المرتبطة بانتشار خلايا البلازما النقوية في التجويف النخاعي. في الواقع ، تنتج خلايا الورم النقوي المتعدد عوامل مختلفة (تجمع في الطائفة OAF ، عامل تنشيط العظم) والذي يسمح لل osteoclasts بتسريع هدم الأنسجة العظمية ، من خلال إعادة الامتصاص. وبما أن بانيات العظم ("منتجي العظام") لا تخضع لنفس المحفزات التكاثريية ، فإن كتلة العظام تنخفض تدريجيًا. هذا يغير بنية النسيج ، مما يجعل العظام هشة وعرضة للكسور وهشاشة العظام وسحق (فقرات). من وجهة النظر الإشعاعية ، فإن إعادة ترتيب العظم واضحة لظهور بقع "مثقبة" ، والتي تتزامن مع المناطق التي يكون فيها تكاثر العظام غير موجود. الزيادة في آفات العظام يمكن أن تزيد أيضا من إطلاق الكالسيوم في الدم (فرط كالسيوم الدم).
- فرط كالسيوم الدم . يؤثر مستوى عال من الكالسيوم في الدم على وظيفة الأعصاب ويسبب العطش الشديد والغثيان والإمساك وفقدان الشهية والارتباك العقلي. ارتفاع نسبة الكالسيوم في الدم يرجع إلى تسلل الخلايا الخبيثة في العظام.
- الفشل الكلوي. عدة عوامل تتدخل في تكييف وظائف الكلى. مستويات عالية من الجلوبيولينات المناعية؟ <monoclonal غير طبيعي (البروتينات؟ <M) ، قد يسبب آفات أنبوبي بسبب ترسبها في الكبيبات (بروتين بنس جونز). تؤدي زيادة ارتشاف العظم إلى فرط كالسيوم الدم وتسبب التهاب كلوي ، مما يساهم في الفشل الكلوي. تشمل الأسباب الأخرى اعتلال الكلية المفرط للورم (من ترسب حمض اليوريك) ، والتسلل المحلي للخلايا الورمية ، والالتهابات المتكررة (التهاب الحويضة والكلية) والأميلويد.
- فقر الدم. في المايلوما المتعددة ، ينبع نقص خلايا الدم الحمراء من عدم إنتاج خلايا الدم "الصحية" لصالح استنساخ الورم في نخاع العظم. يمكن أن يؤدي فقر الدم إلى الوهن والضعف العام وصعوبة التنفس.
هذه المشاكل الأربعة ، الشائعة في المايلوما المتعددة ، يشار إليها غالبًا بالاختصار CRAB ، الذي يشير إلى مستويات الكالسيوم والفشل الكلوي وفقر الدم والأضرار العظمية → C = الكالسيوم (مرتفع) ، R = الفشل الكلوي ، A = فقر الدم ، ب = آفات العظام
قد تتضمن العلامات والأعراض الأخرى للورم النخاعي المتعدد ما يلي:
- الالتهابات : يؤدي انخفاض خلايا الدم البيضاء (نقص الكريات البيض) إلى نقص المناعة ، وبالتالي إلى مقاومة أقل للعدوى. قد تكون هذه من شدة سريرية مختلفة (الالتهاب الرئوي ، التهاب الجيوب الأنفية ، التهابات الجلد ، المثانة أو الكلى) وتمثل السبب الرئيسي لوفاة المرضى الذين يعانون من المايلوما المتعددة. تتضمن فترة الخطر الأكبر لحدوث العدوى الأشهر الأولى بعد بدء العلاج الكيميائي.
- اضطرابات تخثر الدم: يؤدي نقص الصفائح الدموية (نقص الصفيحات الدموية) إلى حدوث تغيرات في عملية تجلط الدم ، والتي تظهر كميل واضح للتسييل. وعموما ، يتم تقليل نصف عمر الصفائح الدموية ويتم تغيير التفاعل مع البطانة الوعائية. تشوهات الارقاء الأخرى تنتج من انخفاض انحلال الفبرين.
- متلازمة Hyperviscosity : في بعض حالات الورم النقوي المتعدد ، لوحظت زيادة في لزوجة البلازما ، مما أدى إلى أعراض نزفية ، واضطرابات عصبية ونقص تروية في الشريان التاجي.
- الاضطرابات العصبية : المظاهر العصبية المرتبطة بالمايلوما المتعددة غير متجانسة. تعتبر أعراض آلام النفاس والضعف أو التنميل في الأطراف هي الأعراض الأكثر شيوعًا. وأخيرا ، قد يكون هناك ألم جذري وضغط للحبل الشوكي بسبب تورط العمود الفقري ، أو متلازمة النفق الرسغي وغيرها من الاعتلالات العصبية الناجمة عن تسلل رواسب اميلويد على مستوى الأعصاب الطرفية.
التشخيص
يمكن للطبيب الكشف عن علامات الورم النقوي المتعدد من خلال اختبارات الدم والبول التي تجرى خلال الفحص البدني الروتيني. إذا كان المريض عديم الأعراض ، يمكن تكرار هذه الاختبارات المعملية بانتظام ، من أجل مراقبة تطور المرض وتحديد أفضل وقت لبدء العلاج. تعد مشاركة الأعضاء معيارًا تشخيصيًا مهمًا للورم النخاعي المتعدد.
الامتحانات المخبرية
في العديد من الحالات ، يثبت اختبار التحري الدموي للدم وجود فقر الدم (Hb <10g / dl). تجعل لطخة الدم المحيطية من الممكن الكشف عن خلايا الدم الحمراء المكدسة (rouleaux) ، نتيجة لزوجة البلازما المتزايدة. في كثير من الأحيان ، تتعايش قلة العدلات وقلة الصفيحات ، والتي تتفاقم في المراحل النهائية من المرض.
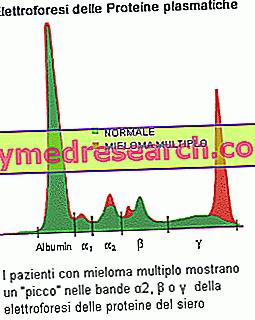
يستطيع الكهربائيون من بروتينات المصل أن يبرهن على وجود البروتينات التي ينتجها الورم المستنسخ: تنشأ الشكوك عن الورم النخاعي إذا كان النطاق (الذروة) ذا صلة بالمظهر الكهربي ، مع مكون M> 30 جم / لتر. ومن النتائج الشائعة الأخرى: بروتين بيانس جونز ، الذي يتميز بوجود البول في بروتينات تتكون من سلاسل خفيفة من النوع أحادي النسيلة. تعد القياسات الكمية لمكون M ضرورية لتشخيص الورم النقوي المتعدد ورصد المرض. اختبارات الدم تؤسس زيادة في معدل ترسيب كريات الدم الحمراء (ESR) وتحديد التغيرات في مستويات الكالسيوم (مرتفعة في الأشخاص الذين لديهم ورم نقوي متعدد متقدم) ، والألبومين (انخفاض مستويات الارتباط مع المايلوما المتقدمة) ، وحامض اليوريك (يوريكيميا) والكرياتينين (يزيد بسبب انخفاض وظيفة الكلى). قد يقوم الطبيب أيضًا بإجراء اختبارات أخرى للتحقق من وجود بيتا 2-ميكروغلوبولين ، وهو بروتين آخر يتم إنتاجه بواسطة خلايا البلازما النقوية. هذا يمكن أن يكون مؤشرا مفيدا في تنظيم المريض: مستويات عالية تشير إلى مرض أكثر تقدما وتوقعات أسوأ.
تقنيات التصوير
يبين المسح الإشعاعي تورط الهيكل العظمي. التصوير بالرنين المغنطيسي أكثر حساسية من التصوير الشعاعي القياسي في الكشف عن الآفات التحليلية وقادر على تحديد وجود إعادة ترتيب العظام مسبقاً.
فحص النخاع العظمي
فحص نخاع العظام يسلط الضوء على عدد من خلايا البلازما: يتطلب أحد متطلبات التشخيص لتعريف الورم النخاعي المتعدد أن كمية الحيوانات المستنسخة من الورم أعلى من 10٪. يتم اختبار جزء من العينة أيضًا لتقييم وجود تغيرات مميزة في النمط النووي ، إما عن طريق علم الوراثة الخلوية التقليدي أو باستخدام تقنيات التهجين الفلوري في الموقع (FISH). تؤثر الشذوذات الكروموسومية الأكثر شيوعًا في المايلوما المتعددة على الكروموسومات 1 و 3 و 5 و 11 و 13 و 14. على وجه الخصوص ، ترتبط أحادية الصبغي للكروموسوم 13 بانخفاض معدل البقاء ، المرتبط بمعدلات عالية من الانتشار ومقاومة الأدوية.
التدريج والتكهن
يمكن للتحقيقات التشخيصية تأكيد الصورة السريرية للمايلوما المتعددة. وعلاوة على ذلك ، تسمح نتائج هذه الاختبارات للطبيب بتصنيف المرض في المرحلة 1 أو 2 أو 3. إن الأشخاص المصابين بالورم المايلي 3 يمثلون علامة أو أكثر من علامات المرض المتقدم ، بما في ذلك عدد أكبر من الحيوانات المستنسخة للورم والفشل الكلوي. وعلاوة على ذلك ، فإن نتائج خزعة النخاع العظمي تسمح للطبيب بتحديد مجمل المخاطر الشخصية للمريض وتطوير أفضل خطة علاجية له.
| التدريج من المايلوما المتعددة (وفقا ل Durie-Salmon) | ||
| المرحلة السريرية | المعلمات | كتلة الورم (عدد الخلايا) |
| المرحلة 1 | كل ما يلي:
| <0.5x1012 / م 2 |
| ملعب 2 | لا شيء من معايير المرحلة الأولى والثالثة | 0،5-1،2x1012 / M2 |
| المرحلة 3 | واحد أو أكثر من الإجراءات التالية:
| > 1،2x1012 / M2 |
يمكن تقسيم المراحل 1 و 2 و 3 من نظام التدوير Durie-Salmon إلى A أو B ، اعتمادًا على كرياتينين المصل:
- ج: الكرياتينين <2 مغ / دل (<177 ملمول / لتر)
- B: كرياتينين المصل> 2 ملغ / ديسيلتر (> 177 ميكرومول / لتر)
في الآونة الأخيرة ، تم اقتراح نظام مرحلي آخر يسمى النظام المرحلي الدولي المتعدد .
مؤشر النذير الدولي للمايلوما (نشره نظام التدريج الدولي - 2005) | ||
مدرج | معايير | معدل البقاء على قيد الحياة (شهور) |
ال |
| 62 |
II | h42-microglobulin <3.5 mg / L و albumin <3.5 g / dl أو β2 ميكروغلوبولين 3.5-5.5 ملغم / لتر بشكل مستقل عن ألبومين المصل | 44 |
III | β2 ميكروغلوبولين ≥ 5.5 ملغم / لتر | 29 |
علاج
لمزيد من المعلومات: أدوية المييلوما المتعددة
يركز علاج الورم النقوي المتعدد على العلاجات التي تقلل من السكان النسيليين. إذا كان المرض غير كامل الأعراض ، فإن الإدارة تقتصر على الملاحظة السريرية. في وجود الأعراض ، يمكن أن يساعد العلاج في تخفيف الألم ، ومضاعفات السيطرة ، وتحقيق الاستقرار في الحالة وإبطاء تطور الورم.
علاج الخط الأول
في السنوات الأخيرة ، أصبح العلاج الكيميائي بجرعة عالية مع زرع الخلايا الجذعية المكونة للدم الذاتي (autotransplantation) الخيار العلاج الأنسب للمرضى تحت سن 65. قبل الطرد التلقائي ، تدار دورة أولية من العلاج الكيميائي الحث ، قادرة على تقليل كتلة الأورام. تتضمن الأنظمة الأكثر شيوعًا استخدام إدارة الثاليدومايد (+ ديكساميثازون) ، بورتيزوميب وليناليوميد (+ ديكساميثازون). العلاج مع الجرعات العالية من العلاج الكيميائي ودعم الخلايا الجذعية (زرع ذاتي) ليس علاجا ، ولكن قد يطيل البقاء العام ويؤدي إلى مغفرة كاملة. زرع الخلايا الجذعية المتجانسة ، أي من شخص سليم إلى المريض المصاب ، يمثل علاجًا محتملًا ، ولكنه متاح فقط لنسبة صغيرة من الحالات السريرية. لا يستطيع المرضى الذين تزيد أعمارهم عن 65 عامًا والذين يعانون من مرض يصاحبه كثيرًا تحمل زراعة الخلايا الجذعية. بالنسبة لهؤلاء الأشخاص ، غالباً ما يتضمن العلاج القياسي العلاج الكيميائي مع melphalan (لمدة 4-7 أيام) المرتبطة بالبريدنيزون (5-10 أيام) ، في دورات تتكرر كل 6 أسابيع ، تليها فترة راحة. في بعض المرضى ، قد يكون من المفيد ارتباط هذا البروتوكول مع نظم علاجية جديدة ، والتي تشمل ، على سبيل المثال ، إدارة بورتيزوميب. هذا الدواء هو مثبط البروتوزوم (وهو مركب متعدد البروتونات موجود في جميع الخلايا) ، والذي يسمح بتحقيق استجابات سريرية كاملة في المرضى الذين يعانون من مرض حراري أو سريع التقدم. ويستند آلية عمل bortezomib على استقراء apoptosis في الخلايا السرطانية ، مما يعوق عمل proteasomes. تم العثور على استجابة سريرية كبيرة في حوالي 50 ٪ من الحالات
العلاج الداعم
بالإضافة إلى المعالجة المباشرة للورم النخاعي المتعدد ، يتم إعطاء البايفوسفونيت (مثل حامض pamidronate أو zoledronic) بشكل روتيني للتحكم في الآفات التحويلية ومنع كسور العظام. تعتبر عمليات نقل الدم المستندة إلى كريات الدم الحمراء والإرثروبويتين مفيدة في تصحيح الأعراض المرتبطة بفقر الدم ، في حين أن إعطاء مركزات الصفائح الدموية يمكن أن يمنع النزيف الناجم عن نقص الصفيحات. تلعب الستيرويدات والبيسفوسفونيت أيضًا دورًا مهمًا في علاج أزمات فرط كالسيوم الدم ، بينما تدعم المضادات الحيوية إدارة العدوى.



