عمومية
طفرة MTHFR هي خلل وراثي يؤثر على إنزيم ميثيلين - تتراهيدروفولات ريدكتاز. ويرتبط هذا الزيغ إلى فرط الهوموسيستئين في الدم (مستويات الهوموسستين البلازمية المرتفعة) ويؤثر على عملية التمثيل الغذائي لحمض الفوليك .

تنتقل الطفرة الجينية MTHFR بطريقة جسمية متنحية وهي مسؤولة عن تقليل نشاط الإنزيم الذي يتم تشفيره. وقد تم تحديد هذه الظاهرة كعامل خطر لتطوير الخثار ، وأمراض الشريان التاجي ، والإجهاض التلقائي وعيوب الأنبوب العصبي .
يتم تنفيذ تحليل الطفرات MTHFR من عينة الدم.
ما
طفرة MTHFR هي خلل وراثي يتسبب في تقليل أو فقدان نشاط إنزيم ميثيلين - تتراهيدروفولات ريدكتاز. نتيجة هذه الظاهرة هي زيادة قيم الهوموسيستئين في الدم ، وفي الوقت نفسه ، الحد من المستويات البلازمية لحمض الفوليك .
جين MTHFR: ما هو؟
يشفر جين MTHFR إنزيما يسمى اختزال methylene-tetrahydrofolate . ويشارك الأخير في تحويل 5،10 - ميثيل - تتراهيدروفولات إلى 5 - ميثيل - تتراهيدروفولات ، وهو جزيء يسمح بإعادة تصنيع الهموسيستين في ميثيونين ، من خلال تدخل فيتامين ب 12 كعامل مساعد.
إن تحويل الهموسيستين إلى ميثيونين هو خطوة استقلابية مهمة للغاية. مستويات عالية من هذه المادة في الدم (hyperhomocysteinemia) يجب أن ترتبط بزيادة في مخاطر القلب والأوعية الدموية والأمراض الأخرى ذات الصلة.
وضع النقل
يمكن أن يكون الجين MTHFR موضوعًا للطفرات التي تنتقل بطريقة متنحية . وهذا يعني أنه يمكن التعبير عن المرض عندما يكون النمط الجيني متماثل الزيجوت ، أي أنه يحتوي على أليلات جينات متحورة (ملاحظة: إذا كان النمط الوراثي متغاير الزيجوت ، يتم تعريف حالة الناقل الصحي).
على المستوى الأوروبي ، تحدث الطفرة MTHFR في 3.5 ٪ من مجموع السكان. يؤثر التغاير الخلوي على حوالي 43-45٪ من الأشخاص (حاملات صحية) ، في حين أن وجود الزيجوتية - أي الحالة التي تنطوي على حدوث المرض - موجودة في 8-15٪ من الحالات.
في الأفراد متماثل ، يتم تخفيض نشاط إنزيم MTHFR بنسبة 50-70 ٪ . هذا يؤدي إلى زيادة في الهموسيستين في الدم (hyperhomocysteinemia) ، وبالتالي زيادة خطر الإصابة بأمراض القلب والأوعية الدموية .
في الحوامل اللواتي يعانين من نقص حمض الفوليك ، يمثل وجود طفرة MTHFR أيضًا عامل اختطار لعيوب الأنبوب العصبي .
ما هو إنزيم MTHFR؟
- إن اختزال ميثيلين - تتراهيدروفولات ( MTHFR ) هو إنزيم يشارك في تحويل 5-10 ميثيلين - تتراهيدروفولات (THF) إلى THF - 5 ميثيل ، وهو الشكل الأكثر وفرة من حمض الفوليك.
- يعمل حمض الفوليك كمانح للميثيل (أو مجموعات الميثيل) في علاج الهوموسيستئين (وهو حمض أميني موجود عادة بكميات صغيرة جدا في خلايا الجسم) إلى ميثيونين (حمض أميني أساسي يمكن أن يستمده الجسم من الغذاء فقط). مطلوب فيتامين B12 لهذا التفاعل ، حفز بواسطة سينثيز ميثيونين. من الناحية العملية ، يقلل إنزيم MTHFR من تركيز الهموسيستين ، ويحوله إلى ميثيونين.
- وتحدد الطفرة إنتاج MTHFR متحور مع نشاط إنزيمي يقل بنسبة 50٪ : نتيجة لذلك ، هناك زيادة في الهموسيستين في الدم ، وبالتالي زيادة خطر الإصابة بأمراض الأوعية الدموية. في حالة نقص حمض الفوليك الغذائي ، فإن وجود الإنزيم المتحور يمثل أيضًا عامل خطر لعيوب الأنبوب العصبي لدى النساء الحوامل.
ما هو الهموسيستين؟
- الطفرة MTHFR هي واحدة من أكثر التعديلات الجينية المشتركة التي ينطوي عليها التمثيل الغذائي في homocysteine .
- Homocysteine هو حمض أميني كبريتية (أي يحتوي على ذرة كبريتية) ، والتي يتم تنظيم عملية الأيض فيها بفضل التدخل الأساسي للأنزيمات والفيتامينات. بمجرد إنتاجها داخل الخلايا ، يتم تحويل هذه المادة بسرعة إلى منتجات أخرى.
- السيطرة على قيم الدم homocysteine ( هوموسستايمين ) يسمح لتشخيص نقص حمض الفوليك أو فيتامين B12.
- تعتبر زيادة مستويات الهوموسيستين في الدم من عوامل الخطر القلبية الوعائية ، مؤهب لتطور تصلب الشرايين ، مرض الشريان التاجي ، السكتة الدماغية وأمراض الأوعية الطرفية بسبب رواسب الدهون.
ما هي طفرة MTHFR C677T؟
إن طفرة MTHFR هي عيب وراثي يعيق تحويل الهموسيستين إلى ميثيونين ، مما يؤدي إلى زيادة في هيموسين الدم ، خاصة في أولئك الذين لا يكون مدخولهم الغذائي من حمض الفوليك هو الأمثل. هذا التعديل يحدد أيضا انخفاض في مستويات تعميم الفولات.
حاليا ، حوالي 40 انحرافات وراثية مختلفة من MTHFR معروفة.
- يتمثل العيب الأكثر شيوعًا في استبدال السيتوزين (C) في الثايمين (T) في النيوكليوتيد في الموضع 677 من جين MTHFR ( طفرة MTHFR C677T أو 677C> T ). هذا يتوافق مع وجود ألانين مع حمض أميني في سلسلة الأحماض الأمينية من متغير الانزيم فيما يتعلق بالشكل الطبيعي. في الموضوعات متماثل الزيجوت لطفرة MTHFR C677T ، يتم تخفيض نشاط الانزيم بنسبة 50 ٪. ترتبط الطفرة MTHFR C677T بمشاكل القلب والأوعية الدموية ، فرط الهوموسستين في الدم ، والصداع النصفي وعيوب الأنبوب العصبي عند بداية الحمل في الثلث الأول من الحمل.
- طفرة أخرى مرتبطة بانخفاض نشاط MTHFR هي استبدال الأدينين (A) مع السيتوزين (C) في الموضع 1298 (المتغير الجيني A1298C). على وجه الخصوص ، حافظت حاملات متماثلة اللواقح على نشاط إنزيم من 60 ٪. ترتبط الطفرة MTHFR A1298C مع الأمعاء المتهيجة ، الألم العضلي الليفي ، والألم المزمن والاضطرابات المزاجية.
الاختلاط المزدوج المتغاير ، أي التواجد المشترك لطفرات MTHFR C677T و A1298C ، يحافظ على نشاط إنزيمي يساوي 50-60٪.
لأنه يقاس
يشار إلى تقييم طفرة MTHFR في الحالات التي يشتبه في الأسباب الجينية وراء الزيادة في الهموسيستين.
يتم تحليل الطفرة MTHFR لأنه يعتبر عامل خطر للأمراض المختلفة ، وخاصة في وجود حمض الفوليك المصاحب أو نقص فيتامين B12 (العوامل المساعدة لإنزيم ميثيلين - تتراهيدروفولات ريدكتاز). وتشمل هذه أمراض القلب والسكتة الدماغية وارتفاع ضغط الدم (ارتفاع ضغط الدم) ، تسمم الحمل (ارتفاع ضغط الدم أثناء الحمل) ، والاضطرابات النفسية وبعض أشكال معينة من السرطان.
متى يتم وصف التحليل؟
قد يشير الطبيب إلى تقييم طفرات MTHFR C677T و A1298C عندما يقدم المريض:
- الألفة لأمراض القلب والأوعية الدموية.
- الجلطات الدموية الوريدية (تخثر وريدي أو انسداد رئوي) ؛
- أمراض القلب والأوعية الدموية مع ظهور سابق لأوانه.
- الإجهاضات الطبيعية المتكررة (poliabortività).
يمكن التوصية بإجراء الاختبار أيضًا قبل استخدام وسائل منع الحمل عن طريق الفم.
يمكن أن يشير الطبيب إلى التقييم كجزء من الفحص السابق للولادة (على السائل الأمنيوسي أو الزغابات المشيمية) والولدان.
الاختبارات ذات الصلة
يمكن الاشتباه في طفرة MTHFR بعد البلازما أو فحص الهوموسين البولية. تتضمن الاختبارات الأخرى المرتبطة ببحث طفرة MTHFR ما يلي:
- جرعات حمض الفوليك (العامل المشترك في علاج الهموسيستين ، بدون هذا ، زيادة مستويات الهموسيستين في البلازما) ؛
- البحث عن طفرات العامل V أو عامل التجلط II ، الذي يمكن أن يؤهب للظاهرة الخثارية.
القيم العادية
كقاعدة عامة ، فإن طفرة MTHFR غير موجودة .
الأمراض المرتبطة
طفرة MTHFR هي المسؤولة عن عدد من الحالات المرضية ، والتي قد تحدث أثناء نمو الجنين (مثل عيوب الأنبوب العصبي) أو أثناء حياة البالغين. وتتنوع نتائج هذه الحالة الشاذة وتشمل التأخر في التطور النفسي-الحركي ، وعيوب الأنبوب العصبي أثناء نمو الجنين (مثل السنسنة المشقوقة) ، والظواهر الخثارية ، والسكتة الدماغية ، والنوبات القلبية ، وانفصال المشيمة ، واضطرابات الخصوبة بشكل عام.
فرط الهوموسستئين في الدم
طفرة MTHFR هي واحدة من أسباب فرط الهوموسستئين (زيادة في مستوى الهموسيستين في البلازما). لا يستطيع الأشخاص المتأثرون تحويل الهموسيستين إلى ميثيونين.
نتيجة فرط الهوموسيستئين في الدم هو زيادة خطر تطوير نوبات التخثر ، السكتات الدماغية ، وتصلب الشرايين واحتشاء عضلة القلب.
الآلية التي بواسطتها فإن زيادة الحمض الاميني ، نتيجة لطفرة MTHFR ، مرتبطة بهذا الاستعداد المتزايد للاضطرابات الوعائية القلبية الوعائية لم يتم فهمها بالكامل بعد ، ولكن يبدو أنها ناجمة عن تغيرات في تجلط الدم والتلف للجدار البطاني للأوعية sanguinei.
يمكن أن يترافق فرط الهوموسستين في الدم مع أعراض وعلامات خفية وغير محددة في البداية ، مثل:
- الإسهال.
- الدوخة.
- الشعور التعب والضعف.
- فقدان الشهيه ؛
- شحوب.
- تسارع ضربات القلب.
- ضيق في التنفس
- ألم في الفم واللسان.
- وخز وخدر و / أو حرق على القدمين واليدين والذراعين والساقين.
يرتبط فرط الهوموسستين في الدم بعدة عواقب أخرى ، مثل الاستعداد لتطوير هشاشة العظام والأمراض العصبية التنكسية (مثل الخرف الخرفي ومرض الزهايمر) والتشنج أثناء الحمل.
في وجود طفرة MTHFR ، يمكن أيضا العثور على الهموسيستين في البول مما يؤدي إلى حالة تعرف باسم هوموسيستينيوريا . يتم القضاء على الهموسيستين ، في الواقع ، من الجسم عن طريق البول ، في شكل سيستين.
وتجدر الإشارة إلى أن الطفرات MTHFR C677T و A1298C تمثل عامل خطر أمراض القلب والأوعية الدموية وخاصة في المرضى الذين يعانون من انخفاض مستويات البلازما من حمض الفوليك (أو فيتامين B9). هذا يؤكد على أهمية ، وبالتالي ، في كل من الوقاية والعلاج ، من المساهمة الغذائية لحمض الفوليك.
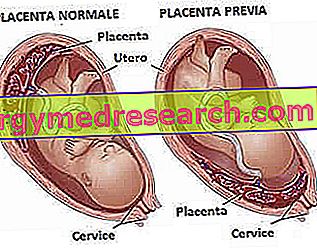
عيوب الأنبوب العصبي
وقد ارتبطت بعض المتغيرات من طفرة MTHFR (تعدد الأشكال الجيني) مع زيادة خطر عيوب الأنبوب العصبي . هذه تتكون من سلسلة من التشوهات الخلقية الثانوية إلى فشل إغلاق الأنبوب العصبي ، أثناء تطور الجهاز العصبي المركزي (17 ° -30 ° يوم من الإباضة).
الأنبوب العصبي هو عبارة عن بنية موجودة في الجنين ، والتي تتطور إلى ظهور المخ والحبل الشوكي. في البداية ، يبدو هذا وكأنه شريط صغير من القماش يتدفق ببطء إلى الداخل. إذا لم تتم هذه العملية بشكل صحيح ، فإن تكوين النخاع الشوكي والدماغ يتم اختراقه بشكل لا رجعة فيه.
اعتمادًا على نوع طفرة MTHFR ووجود عوامل مصاحبة أخرى ، يمكن تطوير العديد من الأمراض التي تتراوح من أشد أشكالها - غير المتوافقة مع الحياة ما بعد الولادة (مثل anencephaly) - إلى الحالات الأكثر اعتدالا ، وتصحيحها جراحيا (مثل الصغرى السحائية).
ANENCEFALIA هي واحدة من الاضطرابات الأكثر شيوعا التي تحدث في حالة طفرة MTHFR. يتميز هذا التشوه الخلقي الخطير بعدم وجود نمو في الدماغ وعظام الجمجمة. لسوء الحظ ، لا تتوافق هذه الحالة مع الحياة: فالأطفال المتأثرون قد يكونوا متوفين للموت قبل أو بعد البقاء لبضع ساعات فقط.
آخر عيب الأنبوب العصبي الناجم عن طفرة MTHFR هو TWIN PLUG . يرجع هذا التشوه في الجهاز العصبي المركزي ، الموجود منذ الولادة ، إلى الإغلاق غير المكتمل لواحد أو أكثر من الفقرات ، أثناء التطور الهيكلي. يتألف هذا الخلل ، على وجه الخصوص ، من نقص الانصهار في خط الوسط لنقطتي تحجر القوس العصبي. والنتيجة هي أن جزءا من الحبل الشوكي يمكن أن يبرز من خلال فتحة في العمود الفقري ، مع تلف دائم في النهايات العصبية. قد تحدث السنسنة المشقوقة أيضا في وجود نقص غذائي لحمض الفولات ، وهذا هو السبب في أن النساء يخططن للحمل ، وفي الأشهر التالية ينصح بشدة بتناول حمض الفوليك كمكمل غذائي.
اضطرابات أخرى
وقد أشارت دراسات علمية مختلفة إلى طفرة MTHFR كعامل خطر محتمل لعدة أمراض أخرى ، بما في ذلك:
- Labiopalatoschisi (العيوب الخلقية التي يوجد فيها انقسام في الشفة العليا وفتحة في سقف الفم) ؛
- ارتفاع ضغط الدم (ارتفاع ضغط الدم) ؛
- تسمم الحمل أو تسمم حملي (زيادة في ضغط الدم أثناء الحمل) ؛
- اضطرابات نفسية
- بعض أشكال السرطان الخاصة.
كيف تقيس
يتم إجراء وجود طفرة MTHFR على عينة دم وريدية.
يشمل التشخيص التقليدي الاختبارات البيوكيميائية لتحديد مستوى الهوموسيستين في الدم . بدلا من ذلك ، فإن التحليل وكتابة الطفرات للجين MTHFR الإنسان مع تقنيات البيولوجيا الجزيئية أمر ممكن .
إعداد
مطلوب أي إعداد خاص قبل جمع الدم مفيدة لتحليل طفرة MTHFR.
تفسير النتائج
نتائج الفحص تشير إلى ما إذا كان المريض حاملة للتغييرات في الجين الذي يشفر أنزيم MTHFR.
ترتبط طفرة MTHFR بمستويات الهوموسستين المرتفعة وانخفاض مستويات الفولات في البلازما.
يعتبر الهموسيستين الزائد في الدم عامل خطر لأمراض القلب والأوعية الدموية والجلطات الدموية الوريدية. في وجود مستويات منخفضة من حامض الفوليك في البلازما ، فإن طفرة MTHFR تزيد من الاستعداد لتطوير هذه الحالات المرضية. هذا يؤكد على أهمية ، وبالتالي ، في كل من الوقاية والعلاج ، من المساهمة الغذائية لحمض الفوليك.
نقص التغذية من هذا العنصر هو أيضا عامل خطر لعيوب الأنبوب العصبي في النساء الحوامل.
لتعرف
للحد من مخاطر عيوب الأنبوب العصبي ، مثل السنسنة المشقوقة ، تنصح النساء اللواتي يخططن للحمل بتعبئة 4 ميلي غرام / يوم حمض الفوليك من فترة ما قبل الحمل (على الأقل قبل شهر واحد من الحمل). ) ، لتستمر حتى الشهر الثالث من الحمل. يمكن مساهمة منخفضة من هذا العنصر خلال فترة الحمل ، في الواقع ، إلى حدوث تشوه يساهم في طفرة MTHFR.