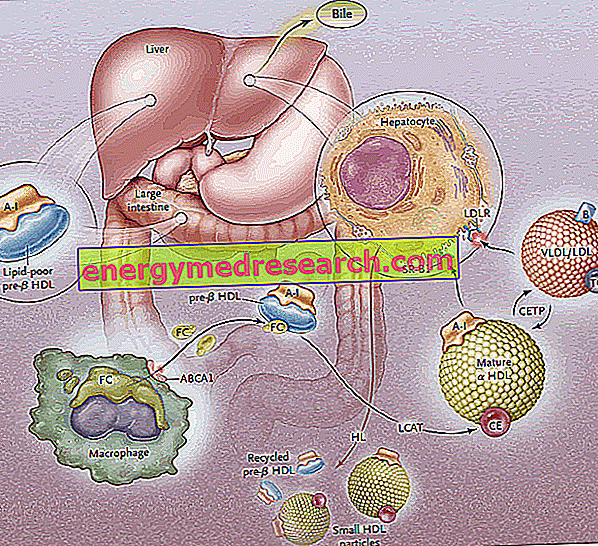
نقل الكوليسترول العكسي (RCT) هو العملية التي يتم بها إزالة الكولسترول من الأنسجة المحيطية ، من خلال دمجها في البروتينات الدهنية عالية الكثافة وما يتبع ذلك من نقل إلى الكبد للإفراز الصفراوي.
الخلايا المحيطية ، مثل كل الخلايا غير المعوية أو الكبدية ، غير قادرة على تحلل الكولسترول الزائد. لذلك ، للحفاظ على التوازن الخلوي ، من الضروري وجود آلية مخصصة لإزالة الكولسترول من الخلايا. وتسمى هذه الآلية ، التي تهدف إلى الانتعاش الكبدي للكولسترول المحيطي الزائد ، "نقل الكوليسترول العكسي" (RCT: نقل الكولسترول العكسي ).
دعونا نفحص العملية بالتفصيل.
يمر تخليق البروتينات الدهنية عالية الكثافة (HDL) من خلال تركيب وإفراز المكونات الأولية للبروتين (apoproteins) ، يليها اكتساب الدهون خارج الخلوية (الدهون الفوسفاتية والكوليسترول) مما يؤدي إلى تجميع وتوليد جزيئات HDL الناضجة.
تتكون المرحلة الأولى من النقل العكسي للكوليسترول في إنتاج الأمعاء والكبد ، من السلائف القرصية من HDL ، والتي تعرض على سطحها للبروتينات apoA-I بشكل رئيسي. وبالتالي يتم إطلاق السلائف من HDL دعا قبل B-HDL ، والتي تتضمن كميات صغيرة جدا من الكوليسترول والدهون ، وخاصة الدهون الفوسفاتية. إن وجود هذه الجزيئات السلائف على المستوى المحيطي يعزز نقل الكوليسترول الحر الزائد (FC) - الذي تسرب من خلايا الأنسجة المحيطية - إلى apo AI ، من خلال تدخل ناقلة غشائية تسمى ATP-cassette A1 (ABCA1). ). يقع هذا الناقل على سطح الخلية وفي أغشية Golولجي ، ويمكن نقل الدهون من جهاز Golولجي إلى غشاء الخلية ، مما يسهل تدفقها. عند هذه النقطة ، بمجرد دخول الكوليسترول الحر إلى HDL الأم ، يتدخل إنزيم بلازما من أصل كبدوي ، يسمى أسيلترانسفيراز lecitin-cholesterol البلازمي أو أكثر LCAT ببساطة ؛ يحول هذا الإنزيم الكولسترول الحر المدمج في ما قبل B-HDL إلى استرات الكوليسترول ، وتحويل ما قبل B-HDL إلى نموذج α-HDL الناضج ؛ من الناحية العملية ، يؤدي التراكم المستمر للكولسترول في قلب البروتين الدهني إلى تحويل HDL القرصي إلى جسيمات كروية و ممتلئة ، والتي يمكن أن تكتسب المزيد من البروتينات البروتينية من جزيئات البروتين الدهني الغنية بالدهون الثلاثية وتتكاثر معًا. في عملية بروتينات صميم البروتينات البروتينية ، تلعب منظمة العفو الدولية دورًا رئيسيًا في تنشيط نشاط ناقل البيانات ABCA1 وأداة النقل LCAT. لأن ApoAI هو البروتين الشحمي الأكثر تمثيلًا على نطاق واسع في HDL ، فإن تركيز البلازما يرتبط ارتباطًا مباشرًا بمستويات الكولسترول HDL.
ملاحظة: عملية الأسترة ضرورية لمنع إعادة إنتشار الكولسترول من HDL إلى غشاء البلازما. هذه الآلية تستغل الأحماض الدهنية في موقع اثنين موجودة في جزيئات phosphatidylcholine.
تقوم عملية الأسترة بوساطة LCAT بتحويل جزيئات ما قبل B-HDL إلى شكلها الكروي "الناضج" α-HDL. ثم يتم نقل هذه البروتينات الدهنية إلى الكبد ، حيث تطلق الكولسترول ، وفقا لمسارين متميزين.
في الحالة الأولى ، ينتج الكوليسترول العالي الكثافة HDL هذا الدهون إلى البروتينات الدهنية الغنية بالدهون الثلاثية (البروتينات الدهنية منخفضة الكثافة منخفضة الكثافة) ، ثم يعترضها الكبد بمستقبلات محددة (LDL-R) ويتم إزالتها من الدورة الدموية. الهدف هو توجيه الكوليسترول المحيطي إلى الكبد من خلال نظام مستقبلات LDL ، وبالتالي "تحميل" HDL من زيادة الكوليسترول إلى المستوى المحيطي ، وذلك لجعله متاحًا مرة أخرى لاستقباله من الأنسجة ؛ أفرغت من الكوليسترول ، HDLs تقبل الدهون الثلاثية في مقابل ذلك ويتم ذلك بفضل بروتين تحويل استر الكوليسترول (CETP). وبالتالي فإن مهمة هذا البروتين هي تعزيز إعادة توزيع وتوازن الكوليسترول وإسترات ثلاثي الغليسيريد بين HDL ، LDL ، IDL ، VLDL ، chylomicrons وبقايا chnomicrons ، مما يؤدي ، كنتيجة صافية ، إلى إثراء في الدهون الثلاثية من HDL ، على حساب استرات الكوليسترول ، وانخفاض في حجم HDL.
يتضمن المسار الثاني مستقبلات الكبد SR-B1 لـ HDL الغنية بالكولسترول esterified ، في غياب التدهور المصاحب للجزء البروتيني من HDL ، والذي يتم إعادة تدويره بعد ذلك. من الناحية العملية ، يسمح لك هذا الإنزيم بإفراغ HDL من محتواه وإعادة تجديد ما قبل B-HDL الجديد. ومع ذلك ، فإن جزء من HDL و ApoA-I يتم تحريفه وتدهوره على مستوى الليزوزومات ، سواء في الخلايا الكبدية أو الكلوية. يتم جعل الإمتصاص بوساطة SR-B1 أكثر كفاءة من خلال نشاط الليباز الكبدي ، القادر على إعادة تشكيل HDL hydrolyzing من phospholipids السطحية ويسمح بتدفق الكولسترول الذي يثبط بواسطة لب البروتين الشحمي نحو غشاء البلازما (من المفترض ، بين البعض الآخر ، هو أن ApoE أيضاً يشارك في الامتصاص الانتقائي ، لأن الفئران الناقصة لجين ApoE تقدم انخفاضاً في فعالية هذا المسار). يتم التعبير عن SR-BI في الغالب في الكبد والغدة الكظرية والمبيض.