الاصول
بدأ تاريخ الأرتيميسين وتأثيراته العلاجية المحتملة في 23 مايو 1967 ، عندما بدأت المجموعة الوطنية للبحث في الأدوية المضادة للملاريا ، التي ضمت أكثر من 600 معهد ، بإجراء فحص مثير للإعجاب لتحديد المكونات النشطة الجديدة مع النشاط ضد الطفيليات.
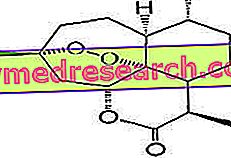
الرقم: الهيكل الكيميائي للأرتيميسين
بعد بضع سنوات فقط ، حوالي عام 1972 ، تم التعرف على الأرتيميسين من مصنع يستخدم عادة في الطب الصيني - Artemisia annua . تم اكتشاف أن هذا العنصر النشط ، من التركيب الكيميائي المعقد ، قادر على ممارسة عمل مضاد للملاريا حتى على الطفيليات المقاومة للعقاقير.
في عام 1976 سمحت الدراسات المختلفة لتوضيح الآلية الرئيسية للعمل من مادة الأرتيميسين . على وجه الخصوص ، فإن هذا السيسكويتربيني الأكسجيني ، بفضل تركيبته الداخلية البولية ، سيكون قادرا على التفاعل مع أيون الحديد ، وتشكيل الجذور الحرة ويؤدي إلى موت الخلية بسبب الصدمة التأكسدية.
التركيز العالي من الحديد داخل البلاسمات الملاريا يبرر القابلية المحددة لهذه الطفيليات إلى عمل الأرتيميسين.
يرجى ملاحظة: يعرف artemisina أيضا باسم qinghaosu .
وجهات النظر العلاجية
تحتوي خلايا الورم أيضًا على تركيزات كبيرة من أيون الحديد داخل الخلايا ، بالإضافة إلى عدد كبير من مستقبلات الغشاء عبر الترانسفيرين (ضروري لالتقاط الحديد خارج الخلية ونقله إلى الخلية).
في الواقع ، أيون الحديد ضروري للحفاظ على معدل المبالغة التقسيم الانقسامي الذي يميز الخلايا الورمية. ليس من المستغرب أن تركيزات مستقبلات الغشاء transembrane ترتبط ارتباطا وثيقا مع عدوانية الورم.
وبسبب تراكيز الحديد المهمة تحديدًا ، تكون الخلايا الخبيثة حساسة من الناحية النظرية لتأثير الأرتيميسين المؤيد للأكسدة ، مما يجعلها في الواقع انتقائية.
على أساس هذه الأدلة ومن هذه الافتراضات ، بدأنا منذ عدة سنوات في تجربة استخدام الأرتيميسين ومشتقاته الأكثر انتقائية ، مثل أرتيسونات ودهيدروارتيميسين (DHA) ، في علم الأورام.
حتى الآن ، فإن الوعود العلاجية الرئيسية لهذه المكونات النشطة تبقى تلك المتعلقة بالأمراض المتعلقة بالأمراض والمناعة.
آليات مكافحة الورم من العمل
وقد سمح الدافع الهائل الذي اكتسبه البحث في التأثير المضاد للأرتيميسين ، الذي أكده العدد المتزايد من الدراسات المنشورة في هذا الصدد ، على الافتراض ، وفي بعض الحالات للتأكيد من خلال النماذج الجزيئية ، عدة آليات محتملة للعمل في هذا المجال. مبدأ attactive
في الوقت الحالي ، يبدو أن خصائص الأرتيميسين ومضاداتها المضادة للأورام تدعمها:
- نشاط مضاد التكاثر : قادر على تنظيم النشاط غير المتوازن للدورة التكرارية التي تميز الخلايا السرطانية. على وجه الخصوص ، يبدو أن هذه المكونات النشطة تتحكم في التعبير عن السايكلنز ، والكينازات النسبية ، التي تشارك في تقدم العملية التكاثريية.
وبالتالي ، سيؤدي كله إلى توقيف انتشار الخلايا.
- نشاط proapoptotic: كما لوحظ في العديد من خطوط الخلايا من السرطان. بتعبير أدق ، يمكن أن تحفز مادة الأرتيميسين ، خاصة عند استخدامها بجرعات عالية ، تنشيط العوامل المؤيدة للأفكارك ، وتحديد تفعيل الآليات البيولوجية المتضمنة في تجزئة الحمض النووي والموت الخلوي اللاحق.
- نشاط antimetastatic : مهم بشكل خاص للنقائل الصغيرة الناشئة في المراحل الأولى من تطور الورم. يبدو أن هذا النوع من الإجراءات يرتبط بقدرة مادة الأرتيميسين على كبح تعبير الميتالوبروتيزات وغيرها من البروتينات التي تنتمي لعائلة الأسبرينات ، التي تشارك في التصاق الخلية الورمية بالمصفوفة خارج الخلية.
- نشاط مضاد لتكوّن الأوعية : من الأدلة التجريبية الأولى ، تظهر قدرة الأرتيميسين على تثبيط التعبير عن عوامل مثل VEGF و FGF ، التي تشارك بشكل كلاسيكي في ظاهرة تكوين الأوعية الدموية. بتعبير أدق ، هذه العوامل من شأنها أن تسهل تكوين هياكل الأوعية الدموية داخل الوصل والبكتيريا ، اللازمة لتغذية كتلة الورم وتسهيل توزيع الدم للمستنسخات الورمية.
- نشاط دعم العلاج الكيميائي: أظهرت الأدلة المثيرة للاهتمام كيف أن إضافة مادة الأرتيميسين ومشتقاته إلى العلاج الكيميائي الكلاسيكي ، يمكن أن تعزز التأثير السام للخلايا للعلاج ، خاصة في حالة عدم وجود أمراض تستجيب بشكل كافٍ أو للأسف مقاومة. لم يتم توضيح آليات عمل هذا النشاط حتى الآن.
الدراسات
على الرغم من أن معظم الدراسات في هذا الصدد لا تزال تجريبية ، ثم أجريت في الغالب على خطوط الخلايا أو النماذج الحيوانية ، حتى الآن البيانات واعدة بشكل خاص ، وذلك بفضل آلية عمل قابلة للتكرار إلى حد ما.
في التجارب المختبرية : أظهرت عدة دراسات النشاط السام للخلايا من الأرتيميسين ومشتقاته على خطوط الخلايا البدينة وأورانوكارسينوما الكلى الفأري.
بتعبير أدق ، حفز 72 ساعة من خطوط الخلايا هذه مع مادة الأرتيميسين أدى إلى تثبيط انتشارها بنسبة 70 إلى 90٪ ، من خلال تحريض العملية الإستماتية والتوقف عن دورة الخلية ، كما يتضح من الأعمال من الطب الجزيئي.
كما تم الحصول على تأثير ممتاز من خلال الجمع بين الأرتيميسين مع الأدوية السامة للخلايا التقليدية وأدوية العلاج الكيميائي ، والتي تستخدم عادة في المجال العلاجي.
في أعقاب هذه الدراسات ، لاحظ برنامج التنمية العلاجية التابع للمعهد الوطني للسرطان الفعالية المثبطة للأرتيميسين ومشتقاته شبه الصناعية أيضًا في خطوط الخلايا لسرطان القولون والثدي والمبيض والجهاز العصبي المركزي. والبنكرياس والرئة ، وضد سرطان الجلد وسرطان الدم.
في اختبارات الجسم الحي - النماذج التجريبية: أدت نجاحات الدراسات المختبرية إلى قيام الباحثين ، المشاركين في مكافحة السرطان ، بتجربة فعالية الأرتيميسين ومشتقاته أيضًا في النماذج التجريبية لسرطان الحيوانات.
في هذه الدراسات ، أجريت في الغالب على أورام صلبة ، لوحظ أن تناول الأرتيميسين يمكن أن يبطئ بشكل كبير من النمو المتسارع للورم ، مما يؤدي ليس فقط إلى تحسين شامل للصورة السريرية ، ولكن أيضا إلى انخفاض كبير في معدل الوفيات .
التجارب السريرية: كما استخدم الأرتيميسين ومشتقاته في التجارب السريرية البشرية وفي حالات سريرية واحدة. وقد لوحظ نجاحات مثيرة للاهتمام لسرطان الخلايا الحرشفية من الحنجرة ، لسرطان الغدة النخامية macrorenoma ولبعض أشكال سرطان الرئة.
في جميع هذه الدراسات ، تم إضافة المكونات النشطة المذكورة أعلاه إلى العلاج الكيميائي الكلاسيكي.
لا يزال العديد من الأبحاث جارية لفهم الإمكانات الإكلينيكية الحقيقية لهذه المشتقات.
سمية الأرتيميسين
على الرغم من عدم وجود دراسات طويلة الأمد ، قادرة على التحقق من التأثيرات السمية المحتملة المرتبطة بالاستخدام العلاجي للأرتيميسين ، تظهر أول الدراسات التجريبية ، على وجه الخصوص جرعات عالية ، خاصة التأثيرات السمية العصبية.
ومع ذلك ، بالإشارة إلى الدراسات المنشورة في الأدبيات المتعلقة باستخدام مادة الأرتيميسين كمضاد للملاريا ، يبدو هذا المكون النشط جيد التحمل عند الجرعات القياسية.
التطبيقات المستقبلية
وقد تم بالفعل ارتيميسين الموصى بها لسنوات بسبب عملها المضادة للملاريا الحساسة.
ومع ذلك ، أثبت هذا المبدأ الفعال في الآونة الأخيرة أنه فعال للغاية ، وقبل كل شيء لإمكاناته القوية في تثبيط الخلايا والسامة للخلايا.
وقد أثبتت الدراسات التجريبية فعالية عالية للأوراميزين ومشتقاته ، مما يجعلها قادرة على توفير بديل علاجي آخر للأطباء ، وخاصة ضد الأورام العدوانية بشكل خاص أو تلك التي لا تستجيب بشكل كاف للعلاج.
ويأمل المشهد العلمي بأكمله ، بناءً على هذه الدراسات الواعدة ، أن تدعم التجارب السريرية المختلفة الموجودة حاليًا الفرضيات العلاجية ، وبالتالي توسيع الخيارات العلاجية المحتملة لصالح الطبيب في مكافحة السرطان.
قائمة المراجع
التأثير التفاضلي لمادة الأرتيميسينين على خطوط الخلايا السرطانية.
Tilaoui M، Mouse HA، Jaafari A، Zyad A.
نات Prod Bioprospect. 2014 يونيو ؛ 4 (3): 189-96.
الأرتيميسنين مشتق مشتق من الحساسية للأشعة في خلايا سرطان عنق الرحم في المختبر وفي الجسم الحي.
Luo J، Zhu W، Tang Y، Cao H، Zhou Y، Ji R، Zhou X، Lu Z، Yang H، Zhang S، Cao J.
راديات أونكول. 2014 25 مارس ؛ 9: 84
تثبيط التآزر من تولد الأوعية بواسطة الأرتيسونات و كابتوبريل في المختبر و في الجسم الحي.
Krusche B، Arend J، Efferth T.
Evid Based Complement Alternat Med. 2013 ؛ 2013: 454783.
[بحث متقدم في الأنشطة المضادة للورم الأرتيميسينين ومشتقاته].
يانغ اتش ، تان اكس جيه.
Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2013 أغسطس ؛ 35 (4): 466-71
يتسبب الأرتيميسينين في موت الخلايا المبرمج في الخلايا السرطانية البشرية.
Singh NP، Lai HC.
مقاومة المضار لعامي 2004 يوليو-أغسطس ؛ 24 (4): 2277-80.
Dihydroartemisinin هو مثبط لنمو خلايا سرطان المبيض.
Jiao Y، Ge CM، Meng QH، Cao JP، Tong J، Fan SJ.
اكتا Pharmacol الخطيئة. يوليو 2007 ؛ 28 (7): 1045-56
النشاط المضاد للورم من الأرتيميسينين ومشتقاته: من عامل مضاد للملاريا معروف إلى عقار محتمل مضاد للسرطان.
Crespo-Ortiz MP، Wei MQ.
ي biomed Biotechnol. 2012؛ 2012: 247597
يحفز Dihydroartemisinin (DHA) موت الخلايا المبرمج المعتمد على caspase-3 في خلايا أرنوكارسينوما سرطان الرئة البشرية.
لو YY ، تشن TS ، تشو JL ، عموم WL ، صن L ، وي XB.
J Biomed Sci. 2009 2 فبراير ؛ 16: 16



