ما هو سوليريس؟
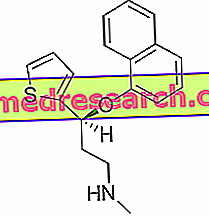
Soliris هو مركز لإعادة تكوينه في محلول من أجل التسريب. يحتوي على المادة الفعالة eculizumab.
ما هو Soliris المستخدمة ل؟
يشار إلى Soliris في علاج المرضى الذين يعانون من الهيموغلوبين الليلي الانتيابي (EPN) ، وهو مرض وراثي نادر يهدد حياة المريض ، مما يؤدي إلى تفكك خلايا الدم الحمراء (التدمير) بسرعة كبيرة. العواقب هي فقر الدم (انخفاض عدد خلايا الدم الحمراء) ، والتخثر (تكوين الجلطة في الأوعية الدموية) والبول الداكن.
بما أن عدد المرضى الذين يعانون من PNH منخفض ، يعتبر المرض "نادر" وتم تعيين Soliris "دواء يتيم" (دواء يستخدم في الأمراض النادرة) في 17 أكتوبر 2003.
لا يمكن الحصول على الدواء إلا بوصفة طبية.
كيف يتم استخدام Soliris؟
يجب أن تدار سوليريس من قبل أخصائي الرعاية الصحية ، مثل الطبيب أو الممرضة ، تحت إشراف طبيب من ذوي الخبرة في علاج المرضى الذين يعانون من اضطرابات الدم.
ويتكون العلاج باستخدام سوليريس من إعطاء عن طريق التسريب (بالتنقيط إلى الوريد) من 600 ملغ من المنتج لمدة 25-45 دقيقة مرة واحدة في الأسبوع ، تليها جرعة 900 مجم خلال الأسبوع الخامس. يجب الحفاظ على الجرعة عند 900 مجم ، كل أسبوعين تقريبًا. يجب أن يتم تطعيم جميع المرضى ضد التهاب السحايا الناجم عن جرثومة النيسرية السحائية ويجب أن يتم إعادة تطعيمهم وفقاً للمبادئ التوجيهية الحالية قبل أسبوعين على الأقل من بدء العلاج مع سوليريس.
يجب إعطاء المرضى الذين يتلقون سوليريس بطاقة خاصة تشرح أعراض بعض أنواع العدوى ، مع تحذير للحصول على عناية طبية فورية في حالة حدوث هذه الأعراض.
كيف يعمل سوليريس؟
المادة الفعالة في Soliris ، eculizumab ، هي جسم مضاد وحيدة النسيلة. إن الجسم المضاد الوحيد النسيلة هو جسم مضاد (نوع من البروتين) مصمم للتعرف على بنية محددة (المستضد) الموجودة في الجسم والارتباط بها. تم تصميم Eculizumab لربط البروتين المكمل C5 ، وهو جزء من نظام الدفاع في الجسم يسمى "مكمل". في مرضى EPN يظهر خلل في بروتين CD59 الموجود على سطح خلايا الدم الحمراء ، والذي عادة ما يمنع المكمل من مهاجمة الخلايا. وكنتيجة لهذا العيب ، فإن المكمل يدمر خلايا الدم الحمراء. عن طريق منع البروتين المكمل C5 ، يمنع eculizumab المكمل من مهاجمة الخلايا ، مما يقلل من تحللها وتخفيف أعراض المرض.
ما هي الدراسات التي أجريت على سوليريس؟
تم اختبار تأثيرات سوليريس لأول مرة في النماذج التجريبية قبل دراستها في البشر.
تمت دراسة سوليريس في دراسة رئيسية واحدة شملت 88 بالغ مع PNH الذين خضعوا ما لا يقل عن أربعة عمليات نقل الدم في العام السابق. تمت مقارنة Soliris مع الدواء الوهمي (علاج وهمي). كانت مقاييس الفعالية الرئيسية هي عدد المرضى الذين بقيت مستويات الهيموجلوبين (وهي بروتين موجود في خلايا الدم الحمراء) أعلى من مستويات الهدف الفردية وعدد عمليات نقل خلايا الدم الحمراء اللازمة خلال أول 26 أسبوعًا من العلاج .
ما الفائدة التي أظهرها سوليريس أثناء الدراسات؟
كان Soliris أكثر فعالية من العلاج الوهمي في تحسين أعراض EPN. في الدراسة الرئيسية ، كان 49 ٪ من المرضى (21 من أصل 43) عولجوا مع سوليريس مستقرين لمستويات خضاب الدم ، ولم يحتاجوا في المتوسط إلى نقل خلايا الدم الحمراء. بالمقارنة ، لم يكن لدى 44 مريضًا ممن تناولوا الدواء الوهمي مستويات مستقرة من الهيموغلوبين وكانوا بحاجة إلى 10 عمليات نقل في المتوسط.
ما هي المخاطر المرتبطة بـ Soliris؟
التأثير الجانبي الأكثر شيوعًا مع سوليريس (يُرى في أكثر من مريض واحد في 10) هو الصداع. للحصول على القائمة الكاملة لجميع الآثار الجانبية التي تم الإبلاغ عنها مع Soliris ، انظر منشور الحزمة.
لا ينبغي أن يستخدم Soliris في الأشخاص الذين قد يكونون حساسين (حساسية) إلى eculizumab أو بروتينات الماوس أو أي من المواد الأخرى ، أو الذين يتأثرون أو يفترض أنهم يعانون من عجز في المكمل الوراثي. بسبب زيادة خطر التهاب السحايا ، لا ينبغي إعطاء Soliris للأشخاص المصابين بالنيسرية السحائية أو الذين لم يتم تطعيمهم ضد هذه البكتيريا.
لماذا تمت الموافقة على Soliris؟
قررت لجنة المنتجات الطبية للاستخدام البشري (CHMP) أن فوائد Soliris تفوق مخاطرها في علاج المرضى الذين يعانون من الهيموغلوبين الليلي الانتيابي (EPN) ، لكنه أشار إلى أن الأدلة على صالح سوليريس يقتصر على المواضيع سبق أن خضعت بالفعل لعمليات نقل الدم. أوصت اللجنة بمنح سوليريس ترخيص تسويق.
ما هي التدابير التي يتم اتخاذها لضمان الاستخدام الآمن لـ Soliris؟
سوف توافق الشركة المنتجة لسوليريس على تفاصيل نظام في كل دولة عضو يضمن أن يتم توزيع المنتج الدوائي فقط بعد التحقق من أن المريض قد تم تطعيمه بشكل مناسب. كما سيوفر للموصين والمرضى معلومات حول سلامة الدواء والتحقق من استخدام الواصفين له بأمان.
مزيد من المعلومات حول Soliris
في 20 يونيو 2007 ، منحت المفوضية الأوروبية تصريح تسويق ساري المفعول في جميع أنحاء الاتحاد الأوروبي لشركة Soliris إلى Alexion Europe SAS.
للحصول على ملخص رأي لجنة المنتجات الطبية اليتيمة على سوليريس ، انقر هنا.
للحصول على النسخة الكاملة لـ EPAR من Soliris ، انقر هنا.
آخر تحديث لهذا الملخص: 04-2009